Mitohondrijska slobodnoradikalska teorija starenja
Starenje je degenerativan proces uzrokovan oštećenjima koja dovode do narušavanja strukture makromolekula, ćelijske disfunkcije, propadanja tkiva i smrti kao konačnog ishoda. Tačni razlozi zbog kojih starimo, ne mogu se sa sigurnošću utvrditi. Predložene su brojne teorije starenja, a u poslednjih nekoliko decenija mitohondrijska slobodnoradikalska teorija starenja (MFRTA – the mitochondrial free radical theory of aging) koju su Harman D. i saradnici predložili šezdesetih godina prošlog veka, izaziva sve više interesovanja.
Sistem za vršenje oksidativne fosforilacije čine pet proteinskih kompleksa kodiranih nuklearnim i mitohondrijskim genomom, i uronjenih u unutrašnju membranu mitohondrija. Četiri kompleksa (I-IV) predstavljaju elektron transportni lanac (ETL) u kojem se vrši oksidacija elektronskih donora, dok peti kompleks predstavlja ATP-sintazu u kojoj se odvija fosforilacija, odnosno dodavanje fosfatne grupe na ADP, usled čega se sintetiše ATP. Osnovne pretpostavke na kojima se temelji mitohondrijska slobodnoradikalska teorija starenja (MFRTA) polaze od činjenice da oštećenja lipida, proteina i mitohondrijske DNK, koja kodira veliki procenat subjedinica kompleksa sistema za oksidativnu fosforilaciju, dovode do neefikasnog transporta elektrona kroz elektron transportni lanac. Glavnim uzročnicima navedenih oštećenja prema MFRTA smatraju se mitohondrijske reaktivne vrste molekulskog kiseonika (mROS-ovi) koje nastaju kao nusproizvd procesa oksidativne fosforilacije. Neefikasan transport elektrona dovodi do „curenja“ elektrona i ponovnog stvaranja mROS-ova. Usled narušene ravnoteže između produkcije ROS-ova sa jedne, i eliminacije ROS-ova praćene reparacijom oksidativnih oštećenja makromolekula sa druge strane, dolazi do pojave oksidativnog stresa.
Mitohondrijske reaktivne vrste molekulskog kiseonika (mROS-ovi)
Reaktivne vrste molekulskog kiseonika predstavljaju izuzetno štetne slobodnoradikalske forme koje u organizmu stupaju u biohemijske reakcije sa makromolekulima (lipidima, proteinima i nukleinksim kiselinama) i tom prilikom dovode do strukturnih i funkcionalnih oštećenja. Najveći procenat ROS-ova, poput superoksid anjon radikala, svakodnevno se sintetiše elektronskim „curenjem“ upravo prilikom sinteze ATP-a u mitohondrijama. Najčešća mesta „curenja“ su kompleksi I i III, a u reaktivne vrste molekulskog kiseonika spadaju superoksid anjon radikal, vodonik peroksid i hidroksil radikal.

Šematski prikaz produkcije mitohondrijskih reaktivnih vrsta molekulskog kiseonika (mROS-ova). Izvor fotografije: https://els-jbs-prod-cdn.jbs.elsevierhealth.com/cms/attachment/543546/3808508/gr1.jpg
Eksperimentalni podaci koji potvrđuju mogući uticaj mROS-ova na proces starenja
Tokom eksperimenata koji su rađeni na mutantima vinskih mušica zapaženo je da delecija gena za mitohondrijsku i citoplazmatičnu superoksid dismutazu (enzim koji reguliše koncentraciju superoksid anjon radikala) za rezultat ima smanjenje životnog veka. Jedan od eksperimenata pokazao je da linije vinskih mušica selektovane za dug život produkuju manju količinu reaktivnih vrsta kiseonika u odnosu na kontrolne linije. Kod obe linije, međutim, produkcija mROS-ova raste sa starenjem jedinki i spregnuta je sa povećanjem neefikasnosti funkcija elektron transportnog lanca.
Biomembrane, zbog svoje karakteristične fosfolipidne građe, takođe mogu biti izložene oksidativnim oštećenjima. Oksidativna oštećenja lipida membrane mogu se javiti direktno, peroksidacijom iniciranom nekim od reaktivnih vrsta molekulskog kiseonika (poput hidroksil radikala ili superoksid anjona) ili indirektno, kroz proizvodnju visokoreaktivnih aldehida. Kardiolipin, glavna komponenta unutrašnje mitohondrijalne membrane, naročito je osetljiv na oksidativni stres. Budući da kardiolipin igra ključnu ulogu u funkciji mitohondrijskih proteina, poput citohrom oksidaze i transportera adeninskih nukleotida (ANT), oštećenja u njegovoj strukturi dovela bi do brojnih potencijalnih komplikacija. Nekoliko sprovedenih studija, takođe, ukazalo je na opadanje koncentracije kardiolipina sa starenjem ćelija srca, jetre i mozga, naročito izraženo u mitohondrijama nesinaptičkih ćelija. Unutrašnja membrana mitohondrija bogata je i proteinima koji čine čak 80% njene ukupne molekulske strukture. Oštećenja proteina, takođe, mogu nastati direktnim izlaganjem reaktivnim vrstama molekulskog kiseonika, ili usled već spomenutih lipidnih oštećenja, imajući u vidu izuzetnu funkcionalnu i fizičku povezanost proteina i lipida membrane.
Nereparirana oksidativna oštećenja nuklearne i mitohondrijske DNK mogla bi uzrokovati brojne komplikacije i uticati na proces starenja. Glavni proizvod oksidacije DNK jeste 8-hidroksi 2-deoksiguanozin (8OH–dG). Jedna od varijanti mitohondrijske slobodnoradikalske teorije starenja uzima isključivo kumulativna oksidativna oštećenja mitohondrijske DNK kao glavne uzročnike procesa starenja, a nekoliko studija pokazalo je znatno viši nivo 8OH-dG u mitohondrijskoj, u nego u nuklearnoj DNK. Mitohondrijska DNK izuzetno je podložna oksidativnim oštećenjima, budući da je lokalizovana u blizini unutrašnje mitohondrijske membrane – mesta produkcije reaktivnih vrsta molekulskog kiseonika, kao i da ne poseduje zaštitne histonske proteine poput nuklearne DNK. Nereparirana oštećenja mtDNK mogu se preneti deobom na naredne generacije mitohondrija, te kasnije i ćelija. Studije rađene na ćelijama centralnog nervnog sistema, ćelijama skeletnih mišića i hepatocitima ljudi pokazuju da se količina mutacija (poput delecija) mtDNK povećava tokom godina. Nameće se pitanje jesu li oksidativna oštećenja mROS-ovima dovela do najvećeg procenta mutacija mtDNK, ili su drugi faktori, poput grešaka u replikaciji, potencijalno izvršili značajniji uticaj.
Pored oštećenja na molekularnom nivou, u brojnim naučnim studijama zabeležene su izvesne morfološke i kvantitativne promene koje su se odrazile upravo na mitohondrije, a koje mogu ukazati na njihovu sveobuhvatnu uključenost u proces starenja. Kod starijih jedinki sisara primećena je izrazita zaobljenost mitohondrija, dok njihova brojnost, kao i brojnost kopija mtDNK, opada sa starenjem ćelija jetre miševa, pacova i ljudi. Komparativna istraživanja rađena na mitohondrijama izolovanim iz ćelija jetre mladih (20 nedelja) i starih (80 nedelja) jedinki miševa, ukazala su na izvesne morfološke kao i strukturne razlike. Kod mitohondrija starijih jedinki, primećene su strukture u vidu pregrada ili praznina u centru organela. Primenom određenih tehnika za 3D vizuelizaciju subćelijskih stuktura, ustanovljeno je da su membrane koje ograničavaju te praznine kontinuirane upravo sa unutrašnjom membranom mitohondrija. Praznine su bile povezane sa međumembranskim prostorom kroz otvore različitih veličina, te se kod nekih pojedinačnih mitohondrija može uočiti matriks u obliku krofne. Funkcije respiratornog lanca, takođe, smanjene su za čak 40% u mitohondrijama jetre i slezine pacova starijih od 24 meseca, za razliku od jedniki starih 3-4 meseca. Slični podaci zabeleženi su ispitivanjem jetre, srca i skeletnih mišića kod ljudi. Važno je, međutim, napomenuti da, iako je starenje praćeno morfološkim promenama i izvesnim slabljenjem mitohondrijskih funkcija, ova činjenica ipak može predstavljati samo posledično stanje, nastalo usled delovanja realnog uzročnika.
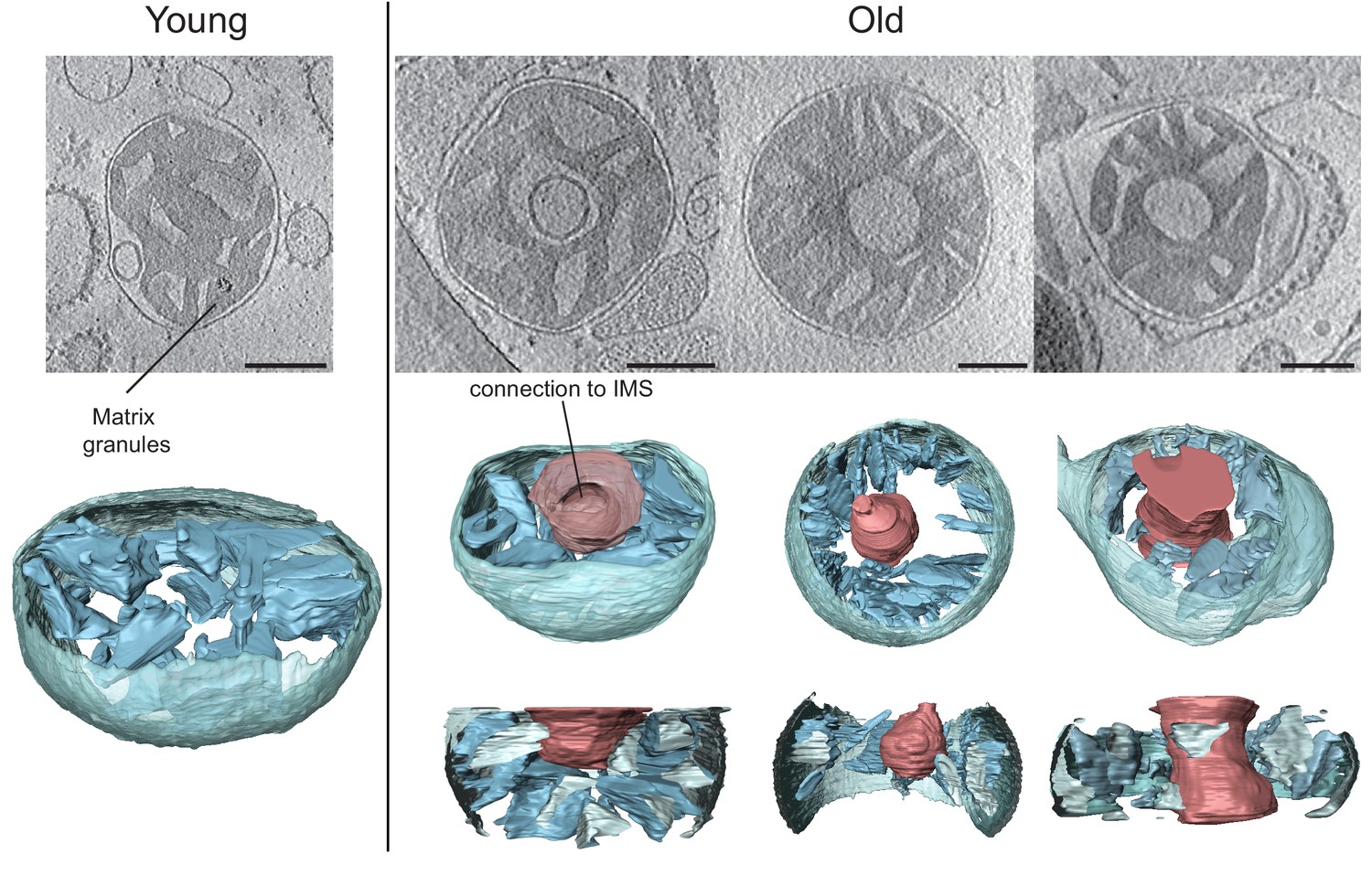 Mikrografije mitohondrija jetre mlade (20 nedelja) i stare (80 nedelja) jedinke pacova. Crvene strukture predstavljaju praznine koje nastaju tokom hronološkog starenja mitohondrija. Izvor fotografije: https://iiif.elifesciences.org/lax/24662%2Felife-24662-fig3-v2.tif/full/1500,/0/default.jpg
Mikrografije mitohondrija jetre mlade (20 nedelja) i stare (80 nedelja) jedinke pacova. Crvene strukture predstavljaju praznine koje nastaju tokom hronološkog starenja mitohondrija. Izvor fotografije: https://iiif.elifesciences.org/lax/24662%2Felife-24662-fig3-v2.tif/full/1500,/0/default.jpg
Iako uočene u ćelijama jetre i još nekih organa, značajne strukturne promene mitohondrija, međutim, nisu pronađene u svim histološkim tipovima, poput srčanog mišićnog tkiva. Ova činjenica, kao i različiti primeri negativne korelacije uticaja mROS-ova i starenja, doprineli su razvoju istraživanja u potpuno novom pravcu.
Iako je starenje još uvek neshvatljiv i neizbežan proces, zdrav život i redovna fizička aktivnost mogu doprineti smanjenju njegovih manifestacija tokom godina, dok će dalji razvoj nauke i tehonologije možda jednoga dana otkriti definitivne uzročnike starenja i razviti mehanizme koji bi suzbili njihovu produkciju.
Izvori:
- Harman, D. 1972., The biologic clock: the mitochondria? J. Am. Geriatr. Soc. 20, 145– 147.
- Bratic, A. & Larsson, N.-G. 2013., The role of mitochondria in aging. J. Clin. Invest. 123, 951–957.
- Duttaroy, A., Paul, A., Kundu, M. & Belton, A. 2003., A Sod2 null mutation confers severely reduced adult life span in Drosophila. Genetics 165, 2295–2299.
- Mirković Đ.S. 2016., Evolucija starenja kod laboratorijskih populacija Acanthoscelides obtectus: uloga mitohondrija i oksidativnog stresa, Doctoral Dissertation, 18-26.
- Ross, R. 2000., Age-specific decrease in aerobic efficiency associated with increase in oxygen free radical production in Drosophila melanogaster. J. Insect Physiol. 46, 1477–1480.
- Brandt, T., Mourier, A., Tain, L. S., Partridge, L., Larsson, N.-G., & Kühlbrandt, W. 2017., Changes of mitochondrial ultrastructure and function during ageing in mice and Drosophila. eLife, 6




