Nekada „otpad”, danas potencijalni lek
Nekodirajuće RNK predstavljaju posebnu klasu RNK molekula, koja ima važnu ulogu u regulaciji ekspresije gena, poznatoj kao RNK interferencija. Ovaj biološki proces podrazumeva inhibiranje ekspresije gena, kao i sinteze određenih proteina posredstvom ncRNK molekula (non – coding RNA).
Ova klasa RNK molekula ujedno predstavlja i oko 90% ljudskog transkribovanog genoma. Međutim, iako su od izuzetnog značaja za ćeliju, mehanizmi kojima male nekodirajuće RNK uspevaju da vrše svoju funkciju i dalje nisu sasvim razjašnjeni. Ono na čemu se danas insistira, jeste uloga ovih molekula u dijagnostici bolesti, a pre svega različitih vrsta maligniteta.
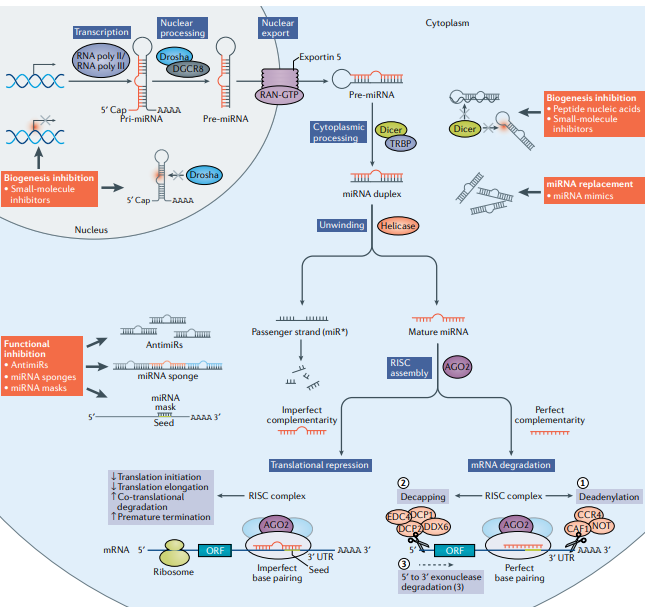
RNK interferencija
Izvor: https://doi.org/10.1038/s41573-021-00219-z
RNK kao biomarkeri malignih oboljenja
Najviše proučene nekodirajuće RNK su lnRNK (long noncoding RNA) i miRNK (micro RNA) i upravo one predstavljaju značajne biomarkere, ne samo kod malignih oboljenja, već i u dijagnostici različitih neuroloških bolesti. Na osnovu prekomerne ili nedovoljne ekspresije tačno određenih vrsta RNK, može se proceniti stadijum oboljenja, tako da je njihova kvantitativna i kvalitativna zastupljenost od visokog terapijskog značaja. Meta ovih molekula su najčešće tumor-supresorni geni, čija je funkcija da kontrolišu rast, deobu i diferencijaciju ćelije. Utišavanje ovih gena od strane nekodirajućih RNK dovodi do proliferacije ćelija, njihovog rasta i migracije.
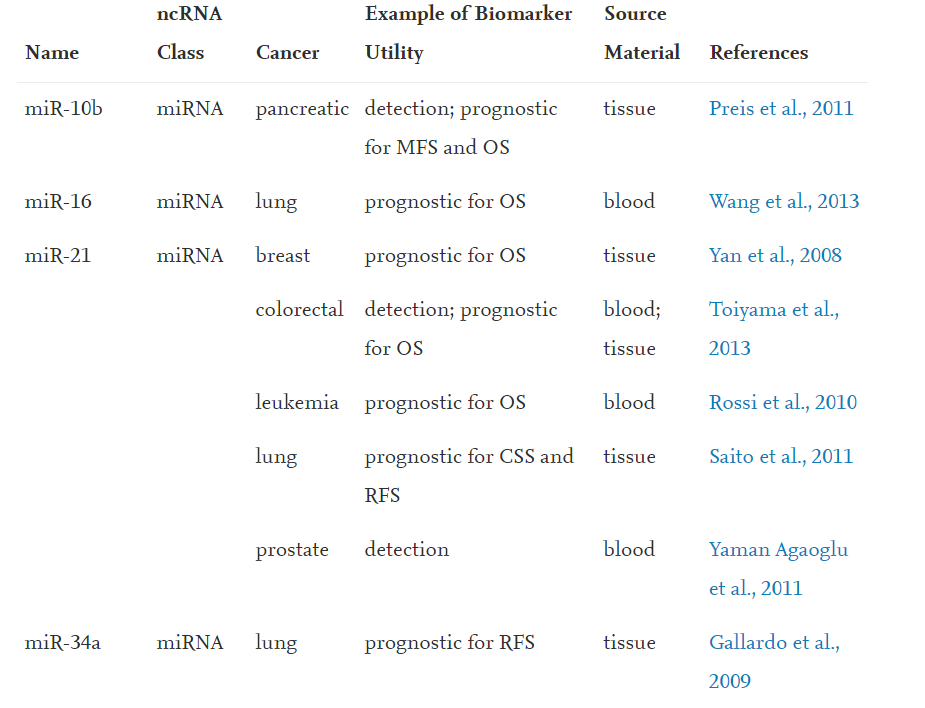
Nekodirajuće RNK kao biomarkeri kod različitih vrsta maligniteta
Izvor: https://doi.org/10.1016/j.cell.2019.10.017
Nekodirajuće RNK u terapiji protiv raka
Maligna oboljenja specifična su po tome što su veoma raznovrsna i jedinstvena, stoga je veliki izazov pronaći pravi lek. Ipak, sve veći značaj u terapiji protiv raka imaju upravo nekodirajuće RNK. Postoje dva moguća pristupa RNK terapije. Prvi podrazumeva obnavljanje tumor-supresornih nekodirajućih RNK kod malignih oboljenja koja se ispoljavaju prilikom njihovog deficita. Drugi način podrazumeva unošenje nekodirajućih RNK, koje kao metu imaju mutirane gene koje mogu utišati i na taj način sprečiti njihovu ekspresiju.
Trenutno je Evropska agencija za lekove (EMA) odobrila 11 terapija zasnovanih na RNK, sa ciljem modifikacije gena u jetri, mišićima ili centralnom nervnom sistemu. Sve ove terapije podrazumevaju unos sintetičkih RNK lanaca, kao što su siRNK (small interfering RNA) ili ASO (antisense oligonucleotides), koji izazivaju specifičnu regulaciju gena. Pored toga, mnoštvo RNK terapija je u fazi II ili III kliničkog razvoja, uključujući i novije terapije bazirane na miRNK.
miRNK su male endogene nekodirajuće RNK koje svoju regulatornu funkciju vrše vezivanjem specifičnih ciljnih informacionih RNK kroz savršenu ili češće, delimičnu komplementarnost sekvenci, što dovodi do inhibicije njihove translacije ili podsticanja njihove degradacije.
siRNK su uglavnom egzogeni molekuli dsRNK (dvolančana RNK), dobijeni iz virusnih RNK ili veštački uvedeni u ćeliju. Upotreba veštački dizajnirane siRNA postala je uobičajena i moćna strategija za inhibiranje ekspresije određenih gena. siRNK su dizajnirane da budu savršeno komplementarne njihovim ciljnim sekvencama za razliku od miRNK koje mogu da regulišu stotine različitih informacionih RNK kroz delimičnu komplementarnost sekvenci.
Prednost novijih terapija zasnovanih na miRNK ogleda se, pre svega, u tome što su u pitanju prirodni molekuli, tako da naše ćelije poseduju sve mehanizme za njihovo procesuiranje i selekciju za određenu metu. Takođe, ovi molekuli imaju sposobnost ciljanja više gena u ćeliji, izazivajući na taj način širi, ali specifičniji odgovor.
Upotreba prirodnih miRNA stoga predstavlja obećavajuću alternativu postojećim RNK terapijama i potencijalno može pojačati terapeutski efekat u poređenju sa sintetičkim siRNK ili ASO koji utiču samo na jedan ciljani gen.
Međutim, RNK terapije još nisu sasvim zaživele, usled nepoželjnih dejstava zbog kojih je većina ispitivanja bila prekinuta. Da bi se uvrstile u terapijsko oružje, male nekodirajuće RNK treba da prođu nekoliko etapa kliničkih ispitivanja, kao što je tačna definicija njihovih meta (kako bi se izbegli neželjeni efekti), savršeno tačno dizajniranje, potvrda na animalnim studijama, optimizacija doze i načina pakovanja RNK molekula (kako bi dospeli u ciljane ćelije). Međutim, sa napretkom nauke i tehnologije, razvijaju se i novi načini RNK terapije, koji za sada najviše obećavaju, prvenstveno zvog visoke specifičnosti i brzog delovanja.
Izvori:
- Winkle, M., El-Daly, S.M., Fabbri, M. et al. Noncoding RNA therapeutics — challenges and potential solutions. Nat Rev Drug Discov 20, 629–651 (2021). https://doi.org/10.1038/s41573-021-00219-z
- Chan, Jia Jia, and Yvonne Tay. “Noncoding RNA: RNA regulatory networks in cancer.” International journal of molecular sciences 19.5 (2018): 1310. https://doi.org/10.3390/ijms19051310
- Laganà, Alessandro, Dennis Shasha, and Carlo Maria Croce. “Synthetic RNAs for gene regulation: design principles and computational tools.” Frontiers in bioengineering and biotechnology 2 (2014): 65. https://doi.org/10.3389/fbioe.2014.00065
- Winkle, M., El-Daly, S.M., Fabbri, M. et al. Noncoding RNA therapeutics — challenges and potential solutions. Nat Rev Drug Discov 20, 629–651 (2021). https://doi.org/10.1038/s41573-021-00219-z
- Slack, Frank J., and Arul M. Chinnaiyan. The role of non-coding RNAs in oncology. Cell 179.5 (2019): 1033-1055. https://doi.org/10.1016/j.cell.2019.10.017